开云手机在线登陆入口潘超云课题组联合中山一院妇科刘军秀、李洁课题组揭示卵巢癌盆腹腔转移的代谢调控机制
盆腹腔转移是卵巢肿瘤常见的转移途径,与患者的不良预后密切相关。肿瘤细胞在转移过程中往往表现出特异的代谢重编程,有望为肿瘤治疗提供重要靶点。2025年4月3日,开云手机在线登陆入口生物化学与分子生物学系潘超云课题组与附属第一医院妇科刘军秀、李洁课题组,联合在Nature Communications杂志上发表题为《A noncanonical role of SAT1 enables anchorage independence and peritoneal metastasis in ovarian cancer》的论文。论文基于系统性代谢限速酶筛选、表观遗传解析、代谢组学、及生化分析等实验,发现多胺代谢酶SAT1(精胺/亚精胺N1-乙酰转移酶1)是驱动卵巢肿瘤细胞盆腹腔转移的关键因素,靶向SAT1是转移性卵巢癌的潜在治疗策略。
原文链接:
https://www.nature.com/articles/s41467-025-58525-8
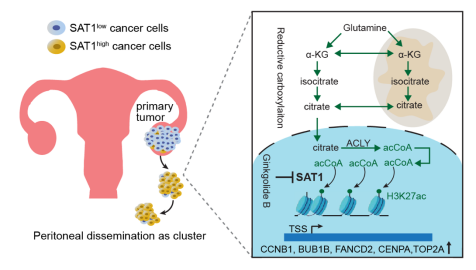
研究发现,低氧诱导SAT1高表达,而SAT1通过促进肿瘤细胞非锚定生存,进而增强盆腹腔转移。SAT1高表达的癌细胞在恶性腹水中普遍存在。SAT1通过直接乙酰化有丝分裂关键调控基因的H3K27结构域,提升其转录水平,进而保护非锚定的转移细胞免于有丝分裂灾难与细胞死亡。SAT1对H3K27的乙酰化作用,依赖于谷氨酰胺通过还原羧化途径提供乙酰辅酶A。研究还发现,药食同源的天然产物银杏内酯B可有效抑制SAT1活性,显著降低小鼠模型中的转移性肿瘤负荷。
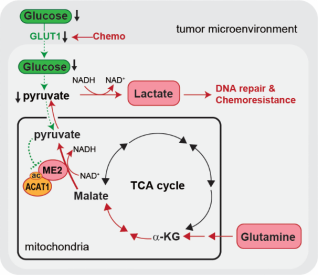
2025年2月14日,潘超云课题组还联合刘军秀、李洁课题组在Advanced Science杂志上发表题为《ACAT1-Mediated ME2 Acetylation Drives Chemoresistance in Ovarian Cancer by Linking Glutaminolysis to Lactate Production》的论文,揭示了化疗压力下的卵巢肿瘤细胞通过谷氨酰胺代谢产生乳酸,进而促进DNA损伤修复与化疗抵抗,为化疗抵抗的代谢调控机制提供新视角。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/advs.202416467
潘超云课题组博士生郑翠苗、卢靖怡,硕士生黄茜是两篇研究论文的共同第一作者。潘超云教授、刘军秀教授、李洁副研究员为通讯作者。该研究得到国家自然科学基金委优秀青年项目、面上项目以及科技部重点研发项目资助。动物实验依托于中山大学实验动物中心完成。中山大学为论文第一单位。



